推定分子量は約30万ダルトンです。
1本のポリペプチド鎖は、約1000残基のアミノ酸で構成されていますで、分子量は約10万ダルトンと計算されています。3本で約30万ダルトンと推定されています。
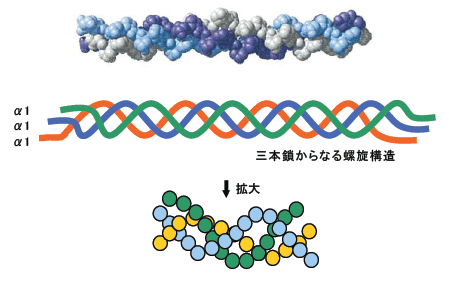
3重らせんは、3本のポリペプチド鎖(各鎖をコラーゲンの場合α鎖と呼んでいます。)が、それぞれ左周りのらせん構造をしています。そして各鎖は、互いにゆるく右周りのらせん状になっています。
この状態をスーパーヘリックスまたはコイルドコイル構造と呼んでいます。
α鎖を構成するアミノ酸の一種であるリシンがヒドロキシル化され、ヒドロキシリシンになり、さらにそのヒドロキシリシンのOH基を介してガラクトース、グルコースが結合している場合があります。つまり、タンパク質であるコラーゲンに糖が結合しているものであります。Ⅱ型コラーゲンの場合も同様です。
この糖部分がエピトープ(抗原決定基)となって、免疫細胞に作用するものと考えられています。
また、トロポコラーゲンの両端は、スーパーヘリックスを構成していない部分があり、この部分はアレルゲンの可能性があると言われています。しかし、コラーゲンはⅡ型に限らず、人間の体の中にはたくさん存在しており、各種のタンパク質の中でも最もアレルギーを起こしにくいものと考えられています。