基礎知識
商品紹介
専門情報
参考資料
2012年12月1日 改定
製品規格書
| 製品名 | バイオマテックジャパン II型コラーゲン(一般食品・健康食品用) |
|---|---|
| 製造・販売 | 株式会社ヘルスマネイジメント |
| 製造場所 | 〒084-0925 北海道釧路市新野24-1056(釧白工業団地) |
| 電話 | 0154-68-4444 |
| FAX | 0154-68-4445 |
| 試験項目 | 規格 | 試験方法 |
|---|---|---|
| 性状 | 淡黄色粉状 わずかに特異な臭いがある | 官能評価 |
| pH | 7.0~10.0 | pHメーター測定 |
| 重金属(鉛) | 20ppm以下 | 原子吸光光度計 |
| ヒ素 | 2ppm以下 | 原子吸光光度計 |
| 窒素 | 11.2~15.2%以下 | アミノ酸自動分析 |
| 強熱残分 | 25.0%以下 | 直接灰化法 |
| ヒドロキシプロリン(Hyp) | 5.6%/100g以上 | アミノ酸自動分析 |
| 非変性Ⅱ型コラーゲン | 75.0%以上 | Hyp×12.51 |
| 乾燥減量 | 10.0%以下 | 乾燥減量試験法 |
| 一般細菌数 | 300CFU/g以下 | 微生物検査 |
| 大腸菌群 | 陰性 | 微生物検査 |
| 備考 | 用途:一般食品用・健康食品用 保存方法:高温多湿を避け、冷暗所で保存してください。 保障期限:出荷日より2年間(冷暗所・未開封) 包装形態:アルミ袋又は真空防湿袋(ナイロン/変性PE/ナイロン) |
|
平成24年12月1日以降出荷分より保証期限を2年間と致しました。
要望により提出しています。
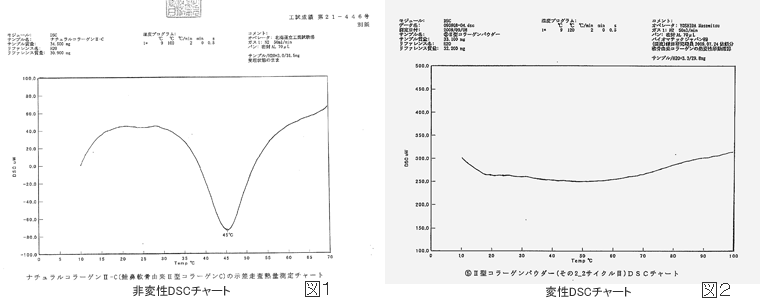
タンパク質が加熱、凍結、紫外線、有機溶剤、酸、塩基、変性剤、海面活性剤等種々の原因により、一次構造は変化しないが、高次構造のみが破壊されることをタンパク質の変性と呼んでいます。コラーゲンの場合は、スーパーヘリックス構造がほどけてしまい、ランダムコイル状のゼラチンになることを変性と呼んでいます。主に加熱によって起こります。変性してスーパーヘリックスが50%破壊された時の温度を変性温度(Tm)と言います。生体の一般的なコラーゲン線維の場合の変性温度は55℃以上と言われています。
図1のチャートは、バイオマテックジャパンⅡ型コラーゲンの示差走査熱量測定チャートです。35℃付近から徐々に変性し、45℃にピークの吸熱反応があることを示しています。変性温度(Tm)は40℃付近だということが判ります。変性してゼラチン化すると、図2のようにフラットになります。また、熱以外の理由により分解して低分子化すると、低温領域にピークが何本も出てきます。しかし、このチャートではそのようなピークは見当たらないことから変性も分解もしていないものと推測できます。しかしこのチャートは、変性の割合を厳密に定量して示しているものではありません。
当社の場合、製造工程で熱を掛ける作業は全くないので、熱変性はありません。
多くのタンパク質は、塩基性で溶解し、酸性では溶解しにくいのですが、不思議なことにコラーゲンは塩基性では溶解度は小さく、酸性で溶解度が高いという特徴があります。バイオマテックジャパンⅡ型コラーゲンは、非変性を目的としているので、他社とは異なり抽出溶媒として溶解度の小さい塩基性物質を使用しており、かつ変性を起こさない非常に低い濃度で使用しておりますので、溶媒による変性の心配もありません。
動物の体温と、その動物のコラーゲンの変性温度(Tm)には相関関係があり、これにはヒドロキシプロリン量が関係していると考えられます。
| 組成項目 | 分析値 | 分析方法 |
|---|---|---|
| 水分 | 1.22% | 常圧加熱乾燥法 |
| タンパク質 | 71.95% | ケルダール法 |
| 炭水化物 | 18.15% | 100-(水分+蛋白+脂質+灰分) |
| 脂質 | 0.41% | ソックスレー抽出法 |
| 灰分 | 8.27% | 直接灰化法 |
| 食物繊維 | - | 酵素-重量法 |
| コンドロイチン硫酸 | 0.02% | カルバゾール硫酸法 |
| ヒアルロン酸 | - | 酵素法 |
| コラーゲン | 66.41% | アミノ酸自動分析 |
| 分子量(Dalton) | - | 高速液体クロマトグラフ法(RI Detector) |
| 組成項目 | 分析値(%) | 分析方法 |
|---|---|---|
| アスパラギン酸 | 6.9 | アミノ酸自動分析 |
| スレオニン | 1.5 | |
| セリン | 4.3 | |
| グルタミン酸 | 10.3 | |
| グリシン | 21.0 | |
| アラニン | 7.3 | |
| バリン | 2.9 | |
| シスチン | 0.0 | |
| メチオニン | 6.0 | |
| イソロイシン | 2.0 | |
| ロイシン | 9.1 | |
| チロシン | 1.3 | |
| フェニルアラニン | 3.0 | |
| トリプトファン | 0.0 | |
| ヒドロキシリジン | 0.0 | |
| リジン | 3.5 | |
| ヒスチジン | 1.2 | |
| アルギニン | 7.7 | |
| プロリン | 9.8 | |
| ヒドロキシプロリン | 6.7 | |
| タウリン | N.D | |
| β-アラニン | N.D | |
| エタノールアミン | N.D | |
| 1-メチルヒスチジン | N.D | |
| 合計 | 100.0 |
本調査は、北海道産の白サケの鼻軟骨から依頼者が独自の技術で抽出、精製したプロテオグリカン及び非変性Ⅱ型コラーゲンを各々15mg、明日葉(ビタミンC)を20mg、乳糖200mgを配合したものを、ハードカプセルに充填・製造したものを1日1カプセル経口摂取することによって行われた。一方、比較するために用いた他社製品は、グルコミサン120mg、コンドロイチン硫酸60mg、コラーゲンペプチド30mg、その他の成分(不明)90mgを配合し、錠剤に成形したものであり、1日10錠経口摂取した。摂取期間はいずれも8週間である。モニターは、40代~60代の男女、当社製品試用群10名、他社製品試用群10名とした。
本調査では、痛みの程度の緩和ならびに膝関節の障害の改善について評価するために、下記3項目について測定し、分析を行った。
また、対象製品に関しては、対象製品の有用性や安全性の観点から、上述の項目に加え、補足的に炎症の程度を示すCRP(C反応性蛋白)についても測定を行った。
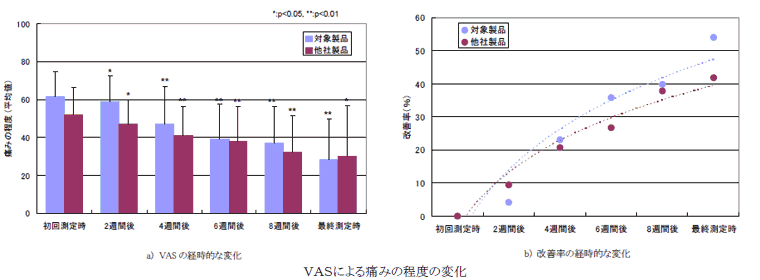
調査の結果、主観的な痛みの程度に関しては、経口摂取開始2週後より有意に低下し、測定終了後まで継続して有意な低下が認められる非常にすばらしい成績を示し、これは、他社製品と比較しても優位な結果であった。
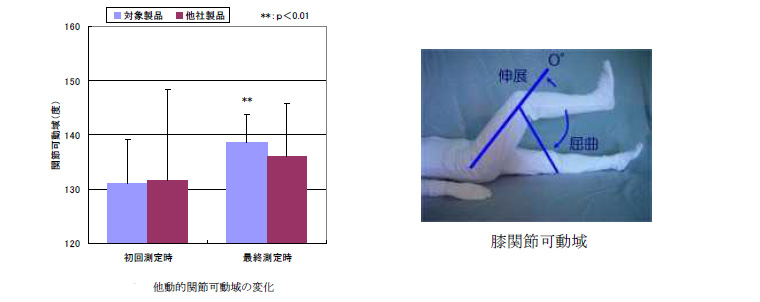
また、関節可動域に関しても、対象製品においてのみ、有意な増加が認められるという非常にすばらしい結果であった。さらに、関節の破壊を示すマーカーであるMMP-3の減少例も他社製品より対象製品が多く、対象製品の成分が体内で有効に働き、効果的に膝軟骨を補強している可能性も示唆された。
これらのことから、対象製品を経口摂取することによって、他社製品と比較しても、膝関節の痛みを軽減・緩和し、関節の可動域を増加させることに有用であることが示唆された。
本試験は試験実施機関である北海道恵庭市の宮脇整形外科の治験審査委員会で討議・承認されたものである。
(1)被験者の選択
試験開始に先立ち、応募した24名から、①関節痛未治療の年齢50歳以上80歳未満、②安静時、階段昇降時あるいは歩行時に膝関節に違和感や痛みがあり、かつ膝の屈折角度が140度以下、③試験前の理学的検査、血液検査などの結果、著しく正常範囲を逸脱せず、試験責任医師が試験参加に支障なしと判断した、以上3項目の条件全てに適合する者をスクリーニングし、同意書にサインした男女8名を被験者として選択した。
(2)試験食品
1錠あたりバイオマテックジャパンⅡ型コラーゲン15mg(非変性Ⅱ型コラーゲンに換算して10.5mg) および賦形剤としてデキストリン(日本食品化工㈱製クラスターデキストリン)185mgを配合した裸錠(以下試験食品) を製造し用いた。
(3)試験デザイン
被験者8名によるオープン試験とした。
(4)用法・用量および検査スケジュール
試験食品を1日1錠就寝前に8週間連日摂取させた。摂取初日、4週目、8週目の前日の21時以降は水以外飲食物を摂らずに来院させ、医師の診察、他動的膝関可動域検査、その他の検査を行った。更に摂取期間中は1週間毎に下記VASおよびJKOMアンケートの記入を義務づけた。
(5)評価基準
1) 有効性
① VAS (Visual analog scale) による膝関節痛の評価
安静時、歩行時および階段昇降時の各場合における膝関節痛の程度を100mmスケール上にプロットすることで被験者が自己評価を行った。
② 日本版変形性膝関節症患者機能評価法(JKOMスコア)による膝状態の評価
膝の痛みの程度、膝の痛みとこわばり、日常生活の状態、ふだんの活動、健康状態などの項目の総合スコアに基づいて評価した。
③ 他動的膝関節可動域検査による膝の屈伸・伸展度の評価
膝関節痛を訴える被験者は、膝の屈曲・伸展が健常人と比較してその可動域が狭まる。本検査はゴニオメーターを用いた数値による客観的な評価法である。
2) 安全性
試験期間中に被験者に生じたあらゆる好ましくない自他覚症状、身体徴候を有害事象として記録した。被験者に記入を義務づけた摂取記録から自覚症状を捉えた。また理学的検査、血液学・血液生化学検査値並びに医師の診察による身体徴候の変化により臨床症状を捉えた。
3) 有用性
バイオマテックジャパンⅡ型コラーゲン を摂取して得られた有効性および安全性評価をもとに、試験責任医師が被験者毎に、さらに全体として有用性を判断した。
(1)被験者の概要
(株)新薬開発研究所が選択した8名の被験者の平均年齢は70.1歳(67歳~75歳、男性3名、女性5名)であった。被験者の試験開始前のVASの合計スコアは、平均160.6mm (98mm~259mm) であり、最も強い膝関節の痛みを100とした場合、平均53.5%の痛みであった。また、他動的膝関節可動域は屈曲角度の平均は138.1度、伸展角度は5.0度であった。
(2) 有効性試験
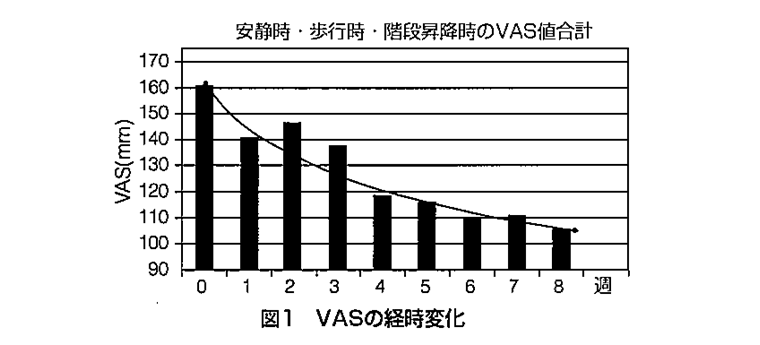
① VASによる試験結果
摂取期間の経過とともに安静時、歩行時および階段昇降時並びにその合計VASスコア値のいずれにも減少が認められた(図1参照)。摂取8週目のVAS合計値で比較すると摂取前に比べ34.2%の改善率であった。他社製品との群間比較を行った前回の試験におけるVAS値の改善率は、39.8%であり、VAS値の低下した被験者は10名中7名であった。
バイオマテックジャパンⅡ型コラーゲン単独の今回の効果は、前回試験の膝関節痛の改善効果とほぼ同等であることが確認された。
② JKOMアンケートを用いての膝関節痛改善に対する試験結果
膝の痛みやこわばり、日常生活の状態の項目では摂取期間の経過とともにスコアの低下が認められた。ふだんの活動、健康状況については統計学的な有意差は認められないものの、スコアの低下傾向が認められた。合計スコアでは、摂取開始時に比較して摂取2週目以降で有意な低下が認められた(表1参照)。
表1 JKOM合計スコアの変化
| JKOM合計スコア | ||||||||
|---|---|---|---|---|---|---|---|---|
| 被験者No. | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 摂取前 | 42 | 50 | 34 | 66 | 37 | 51 | 39 | 32 |
| 摂取4週後 | 36 (-14.3%) |
34 (-32%) |
14 (-68.2%) |
47 (-28.8%) |
32 (-13.5%) |
42 (-17.6%) |
30 (-23.1%) |
23 (-28.1%) |
| 摂取8週後 | 28 (33.4-%) |
13 (-74.0%) |
12 (-74.7%) |
39 (-40.1%) |
40 (-8.1%) |
21 (-58.2%) |
17 (-56.4%) |
36 (-12.5%) |
③ 他動的膝関節可動域検査
痛みのある膝関節を対象として、ゴニオメータを使って摂取前、4週後および8週後に測定した (図1参照) 。膝の屈曲側角度は、摂取4週後および8週後では有意な増加が認められた。また、伸展角度については伸展が不自由な験者が8名中4名でバラツキが大きく、有意差は認められなかった。
④ 有効性についてのまとめ
3方法による有効性評価試験においてバイオマテックジャパンⅡ型コラーゲンは膝関節痛改善効果を示した。摂取2週後の早期からVASおよびJKOMアンケートで効果が認められた。摂取8週後のVASの改善効果は安静歩行時および階段昇降時それぞれ47.2%、29.0%、28.5%であり、特に安静時での改善効果が高かった。合計スコアにおける改善率は摂取4週後26.0%、8週後では34.2%であった。
VASおよびJKOMアンケートの成績から、膝関節痛の改善が認められた被験者は8名中6名であった。
他動的膝関節可動域検査では8名中5名に膝屈曲側に統計的に有意な改善が認められ、伸展側でも4例中3例に改善効果が観察された。
前回の臨床試験での効果とほぼ同程度であり、前回の3種配合食品の効果のかなりの部分はバイオマテックジャパンⅡ型コラーゲンによることが推察された。
(3) 安全性試験
① 自覚症状及び医師診察所見
摂取4週及び8週後の医師診察所見では、バイオマテックジャパンⅡ型コラーゲン摂取に伴う体調不良、臨床症状の長期化や悪化は認められなかった。
② 血液学的検査
バイオマテックジャパンⅡ型コラーゲンの摂取前と4週および8週後の赤血球数、白血球数、血色素量、ヘマトクリット値、血小板数に殆ど変化が認められなかった。このことから、血液凝固系、骨髄系、貧血への影響の可能性はなく、バイオマテックジャパンⅡ型コラーゲンは血液系には作用しないことが示唆された。
③ 血液生化学的検査
血液生化学的検査では、いくつかの項目において変動が認められたが、変動の程度は軽度であり、試験責任医師の診察の結果、健康上問題はないと判断された。
④ 理学的パラメーターに対するバイオマテックジャパンⅡ型コラーゲンの作用
被験者の体重、血圧などに多少の変動が認められたが、変動の程度は軽度であり、試験責任医師の診察の結果、健康上問題はないと判断された。
⑤ 尿検査結果
尿検査においても有意な変動は認められなかった。
